Ky开元集团手机版
移动端访问更便捷药品注册检验新规8月实施 样品缩减时限加速惠及患者
2025年07月22日 08:32:01
来源:Ky开元集团 作者:宋池 点击量:521
国家药监局7月14日批准发布《药品注册检验工作程序和技术要求规范(2025年修订版)》,新规将于8月1日起实施。该规范通过显著减少注册检验样品用量、缩短检验时限、优化工作流程等多项举措,着力提升检验效率。
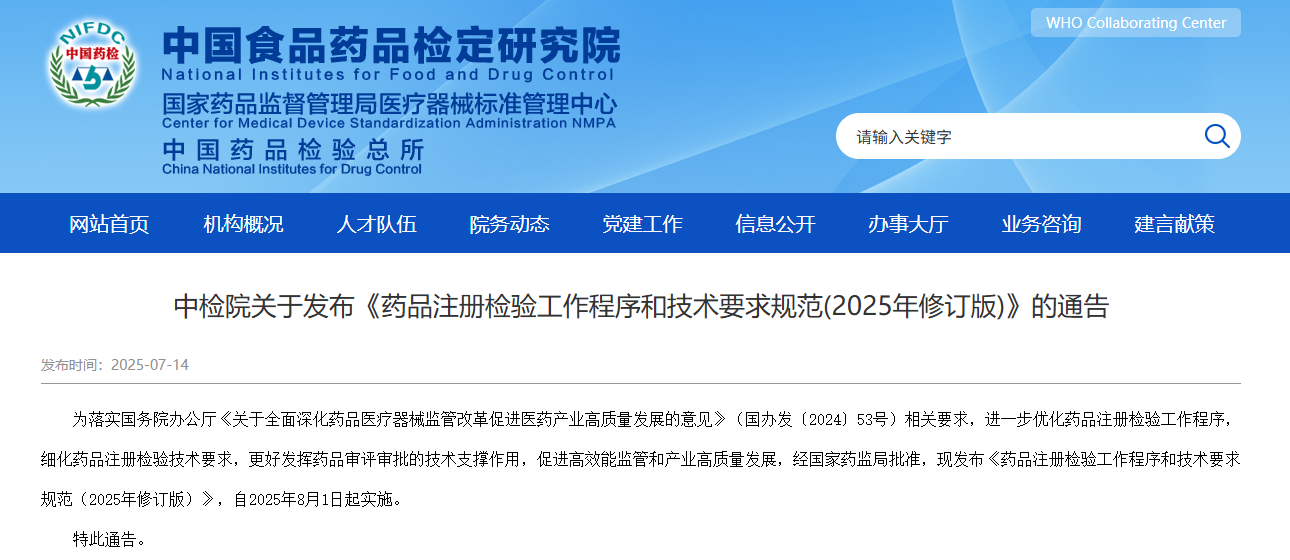
国家药监局7月14日正式批准中国食品药品检定研究院(中检院)发布《药品注册检验工作程序和技术要求规范(2025年修订版)》(以下简称《规范》),新规将于2025年8月1日起实施。
该《规范》旨在落实国务院深化药品医疗器械监管改革部署,紧密衔接药品审评审批要求,着力解决企业申报痛点,提升注册检验质效。核心举措包括减少注册检验样品用量、缩短检验时限、优化工作程序等,以助力药品,尤其是临床急需药和罕见病药品更快惠及患者。
《规范》显著扩大了前置注册检验的适用范围,将其由仅适用于药品上市申请扩展至上市后补充申请,此举有望加速上市后补充申请的审评效率。在样品要求方面,普通药品注册检验每批样品量由原质量标准全项检验所需3倍量减少至2倍量;罕见病药品注册检验所需样品则大幅简化,从3批9倍量减少至1批2倍量。同时,对于剩余有效期略不足的样品,允许在满足检验需要的前提下,经企业与检验机构协商后使用。
在检验时限上,《规范》在维持样品检验60个工作日、样品检验加标准复核90个工作日的基础要求上,明确缩短特定药品检验时间:纳入优先审评审批品种的检验时限缩短10个工作日;临床急需境外已上市境内未上市的罕见病药品检验时限缩短20个工作日。对于审评过程中启动的注册检验,检验机构需优先处理并加快完成。检验机构还需为优先审评审批品种的注册检验申请建立并执行优先检验程序,或按国家药监局要求优先调配资源,加速完成检验。
流程优化方面,《规范》明确允许在满足条件时调用原送检样品留样用于审评中启动的检验;加强检验过程中与企业的沟通,接受质量标准勘误或解释说明,以减少审评中重复启动检验;并优化了样品包装规格及多规格制剂的要求,为企业备样提供更清晰指导。
中检院表示,将协同全国药品检验机构,积极落实《规范》要求,践行“讲政治、强监管、保安全、促发展、惠民生”的监管工作方针,致力于提升药品监管效能,推动医药产业高质量发展。
素材来源:中国食品药品检定研究院
相关阅读 Related Reading
查看更多+-
第十一批药品集采初步确定将对55种药品进行采购,包括抗感染、抗肿瘤、抗过敏哮喘、糖尿病用药、心血管用药、神经系统药物等。2025-07-16 13:56:43
-
2024年检验检测机构国产仪器共992.51万台套,国产替代率创新高!
截至2024年底,我国检验检测机构共有仪器设备1067.01万台套,同比增长3.87%。其中,国产仪器设备992.51万台套,同比...2025-07-15 10:46:19 -
我国上半年批准创新药43个、创新医疗器械45个,同比分别增长59%和87%。其中,上半年新批准儿童药品70个,罕见病用药21个。2025-07-09 10:31:13
-
项目名称:无菌啮齿动物隔离包,项目编号:2523-254GXGJ05001,招标范围:无菌啮齿动物隔离包(1套),招标机构:上海公...2025-07-03 14:14:56
-
国家医保局发布征求意见稿,2025年将制定第一版商业健康保险创新药品目录,主要纳入超出保基本定位、暂时无法纳入基本目录,但创新程度...2025-07-02 11:51:50
版权与免责声明
- ①凡本网注明“来源:Ky开元集团”的所有作品,均为浙江兴旺宝明通网络有限公司-Ky开元集团合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其他方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:Ky开元集团”。违反上述声明者,本网将追究其相关法律责任。
- ②本网转载并注明自其他来源(非Ky开元集团)的作品,目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
- ③如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。