层流剪切应力通过 miR-29b-3p/CX3CL1 轴减轻单核细胞黏附与动脉粥样硬化
Laminar shear stress alleviates monocyte adhesion and atherosclerosis development via miR-29b-3p/CX3CL1 axis regulation
Keywords: Laminar shear stress, Atherosclerosis, CX3CL1, Monocyte adhesion, MiR-29b-3p
流体剪切应力是血流作用于血管内皮的摩擦力,血管内皮细胞能将其变化转化为生物信号,调节生理过程。血流状态决定剪切应力形式,直行血管产生层流剪切应力(Lss),血管分支、分叉或弯曲处则出现振荡或湍流。大量研究表明,直行血管 AS 发病率低,分叉和弯曲处发病率高,意味着 Lss 具有重要抗 AS 作用。
CX3CL1 作为由 373 个氨基酸组成的 CX3C 趋化因子家族成员,以分泌型和膜结合型两种形式存在,兼具趋化因子和黏附分子双重功能,与神经系统疾病、骨代谢疾病和心血管疾病等多种系统性疾病相关,其可介导单核细胞迁移黏附,促使单核细胞募集至血管壁破坏内皮细胞功能并诱导 AS 斑块形成。而低剪切应力会激活 CX3CL1 诱导单核细胞黏附于激活的内皮细胞,Lss 则能降低 CX3CL1 表达以抑制 AS 进展。miRNAs 可通过调控细胞生长、分化等多种生物过程在疾病发生发展中起关键作用,且 Lss 能通过调控 miRNAs 维持内皮细胞功能稳定来发挥抗 AS 作用。
基于此,吉林大学基础医学院人兽共患病教育部重点实验室的研究团队结合生物信息学和分子生物学等方法,对 Lss 敏感的 miR - 29b - 3p/CX3CL1 轴在体内和体外对内皮细胞炎症及 AS 发生发展的影响进行探究。研究成果发表在 Journal of cell science 期刊题为“Laminar shear stress alleviates monocyte adhesion and atherosclerosis development via miR-29b-3p/CX3CL1 axis regulation”。

首先,为了鉴定人主动脉内皮细胞中 Lss 敏感的 mRNA,研究对静态和 Lss 处理的 HAECs、HUVECs 进行全转录组测序,通过 edgR 软件筛选出差异表达 mRNA。结果发现,与静态组相比,Lss 组中 452 个 mRNA 表达显著改变(图 1A),其中 297 个上调、155 个下调(图 1C)。此外,通过分析高通量测序数据,对比HUVECs - 静态组与 HUVECs-Lss 组,发现 Lss 组中 1349 个 mRNA 表达显著改变(图 1B),其中 496 个上调、853 个下调(图 1D)。为探究 Lss 对血管内皮细胞功能的影响,研究发现在 Lss 处理的 HAECs 和 HUVECs 中均下调的 25 个 mRNA 作为关键 mRNA(图 1E;表 1), 其富集的 GO 功能和 KEGG 通路与 AS 发生发展密切相关(图 1F-J), 构建的 PPI 网络包含 21 个节点和 36 条边(图 1K,L)。研究表明,CXCR4、APLN、CX3CL1、CSF1 和 HES1 参与 AS 发生发展。通过 qRT-PCR 检测发现,Lss 处理的 HAECs 中 CX3CL1、CSF1 和 HES1 的 mRNA 表达降低(图 1M),其中 CX3CL1显著下调,且在 HUVECs 中也得到验证(图 1N)。同时 HAECs-Lss 组的细胞上清液和细胞内蛋白表达量均较静态组降低(图 1O-Q)。上述结果表明,Lss 可降低内皮细胞中 CX3CL1 的 mRNA 和蛋白表达,证实 CX3CL1 是 Lss 敏感基因。
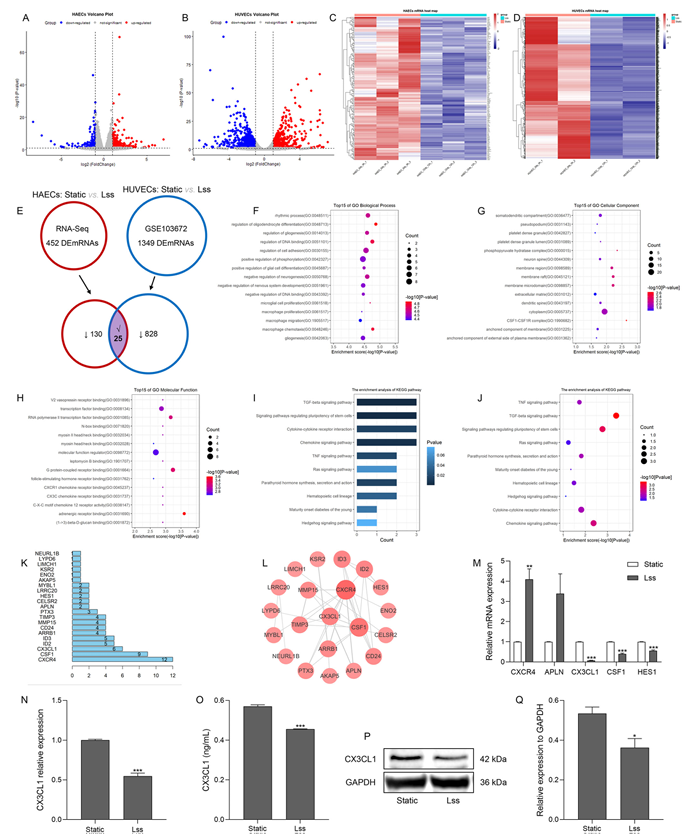
图1 在低切应力条件下,内皮细胞的 CX3CL1 表达下调。
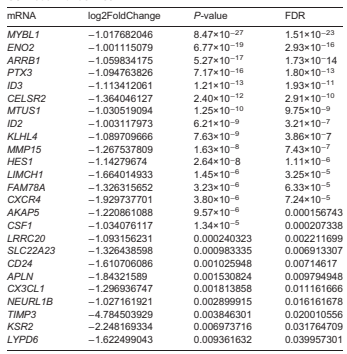
表 1 在低切应力条件下,GSE103672 数据集中 HAECs 和 HUVECs 中均下调的 mRNA。
为了探究 CX3CL1 对人主动脉内皮细胞(HAECs)生物学功能的影响,研究通过转染RNA(shRNAs)构建了 CX3CL1 敲低的细胞模型。结果显示 sh-CX3CL1-1 的敲低效率高(图 2A ),故选取其用于后续研究,而 sh-CX3CL1-3 转染后 CX3CL1 表达量急剧增加的原因尚不明确。 研究表明,内皮细胞 CX3CL1 可诱导单核细胞黏附并损害血管内皮功能。qRT-PCR 和 western blotting 显示,TNF-α 能诱导 HAECs 中 CX3CL1、VCAM-1 和 ICAM-1 的 mRNA 及蛋白表达升高,而转染 sh-CX3CL1-1 可抑制这些分子的表达(图 2B-D)。同时 CX3CL1 表达降低会抑制 TNF-α 刺激的单核细胞黏附增强(图 2E-F)。
接着,为了探究 Lss 是否通过调控 CX3CL1 影响内皮细胞功能,研究构建了 CX3CL1 过表达 HAECs 模型(图 2G)。结果显示 Lss 可显著抑制 TNF-α 刺激引起的 CX3CL1、VCAM-1 和 ICAM-1 表达升高,而 CX3CL1 过表达则逆转了 Lss 的这一抑制作用(图 2H-J)。且单核细胞黏附分析表明,CX3CL1 过表达部分逆转了 Lss 对 TNF-α 刺激的单核细胞黏附增强的抑制效应(图 2K-L)。这些结果表明, Lss 通过抑制 CX3CL1 表达来减弱单核细胞对激活的 HAECs 的黏附。

图 2 低切应力通过抑制 CX3CL1 的表达,损害单核细胞与激活的 HAECs的黏附。
miRNA 表达对流体剪切应力敏感,且受其调控的 miRNA 是心血管疾病治疗潜在靶点,为了分析 Lss 保护内皮细胞功能的分子机制,研究对响应 Lss 调控 CX3CL1 表达的上游 miRNA进行研究。研究通过借助 TargetScan 和 DIANA TOOLS 数据库预测到 miR-424-5p、miR-497-5p、miR-29c-3p、miR-29a-3p 和 miR-29b-3p 这 5 个与 CX3CL1 存在保守结合位点的上游 miRNA(图 3A,表 2)。qRT-PCR 显示 Lss 处理后 miR-29b-3p 表达上调显著(图 3B)。为进一步证实 miR-29b-3p 与 CX3CL1 的相互作用 ,研究构建 CX3CL1-3′UTR 野生型和突变型的荧光素酶报告基因载体,以及 miR-29b-3p 模拟物和阴性对照。结果显示 miR-29b-3p 过表达显著抑制野生型载体的荧光素酶活性,突变型则无此效果(图 3D)。在 HAECs 中构建的 miR-29b-3p 过表达或敲低模型后,miR-29b-3p 的表达相应地上调或下调,表明成功构建了 miR-29b-3p 过表达或敲低的细胞模型(图 3E,I)。进一步验证显示,miR-29b-3p 的过表达抑制了 CX3CL1 的 mRNA 和蛋白表达,而 miR-29b-3p 的敲低则促进了 CX3CL1 的 mRNA 和蛋白表达(图 3F-H,J-L)。上述结果证实 CX3CL1 是 miR-29b-3p 的直接靶基因。

图 3 CX3CL1 是 miR-29b-3p 的直接靶基因。

表 2 利用 TargetScan 和 DIANA TOOLS 预测的可能结合 CX3CL1 的 miRNAs。
如图 4A 所示,TNF-α 可诱导 HAECs 中 miR-29b-3p 表达下调,而转染 pri-miR-29b-3p 可恢复 miR-29b-3p 的表达,表明在 TNF-α 激活的 HAECs 中成功实现了 miR-29b-3p 的过表达。接下来,对miR-29b-3p 是否在 TNF-α 激活的 HAECs 中调控 CX3CL1 的表达进行了研究。qRT-PCR 和 western blotting 结果显示,miR-29b-3p 过表达能显著抑制 TNF-α 诱导的 CX3CL1、VCAM-1和ICAM-1的 mRNA 及蛋白表达升高,并抑制单核细胞黏附增强(图 4B-I)。
为了进一步验证 miR-29b-3p 是否通过调控 CX3CL1 抑制单核细胞黏附,将 pri-miR-29b-3p 与 pri-CX3CL1 共转染至 TNF-α 激活的 HAECs 中。结果发现,在 TNF-α 激活的 HAECs 中 ,CX3CL1 过表达可消除 miR-29b-3p 对 CX3CL1、VCAM-1、ICAM-1 表达及单核细胞黏附的抑制作用(4J-N)。此外,在施加 Lss 条件下,敲低 miR-29b-3p 可逆转 Lss 对 TNF-α 诱导的 CX3CL1、VCAM-1、ICAM-1 表达及单核细胞黏附的抑制效应(图 4R,S)。综上,研究证实 Lss 通过调控 miR-29b-3p/CX3CL1 轴,抑制 CX3CL1 及其下游黏附分子表达,从而减弱单核细胞对激活的 HAECs 的黏附。
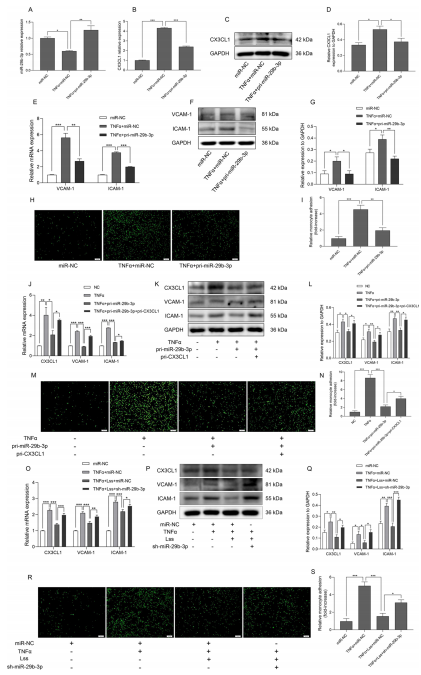
图 4 低切应力通过调控 miR-29b-3p/CX3CL1 轴损害单核细胞与激活的 HAECs 的黏附。
NF-κB 信号通路在炎症调控中发挥关键作用,已有研究表明内皮 miRNA 可通过调节该通路影响单核细胞黏附。为了明确 Lss 敏感的miR-29b-3p/CX3CL1 轴调控内皮细胞黏附的分子机制,研究分析了其对 TNF-α 激活的HAECs 中NF-κB 信号通路的影响。实验显示,Lss 能抑制 TNF-α 诱导的VCAM-1、ICAM-1 上调,显著抑制 TNF-α 诱导的 p65 和 IκBα 的磷酸化(图 5A,B),并且Lss 显著减少了 p65的积累和核转位(图 5C-F),表明 Lss 可通过抑制 NF-κB 信号激活调节内皮炎症。敲低 miR-29b-3p 会逆转 Lss 对 NF-κB 信号通路的抑制作用(图 5E)。此外,miR-29b-3p 过表达或 CX3CL1 敲低均能显著抑制 TNF-α 刺激下VCAM-1、ICAM-1 的上调及 p65、IκBα 磷酸化图 (5G,H ),减少 p65 核积累与核转位(图 5I-K)。综上,Lss 敏感的 miR-29b-3p/CX3CL1 轴通过阻断 NF-κB 信号通路,减轻内皮细胞炎症反应。

图5 低切应力敏感的 miR-29b-3p/CX3CL1 轴通过阻断 HAECs 中的 NF-κB 信号通路来缓解炎症。
最后,为了在体内验证 Lss 与 miR-29b-3p、CX3CL1 的关联,研究检测了 ApoE?/?小鼠主动脉弓(湍流 Oss 作用)和胸降主动脉(Lss 作用)内膜中相关分子的表达,发现 Lss 作用的胸主动脉内膜中 miR-29b-3p 表达上调,CX3CL1 表达下调,而主动脉弓的结果与之相反;体外实验也表明,振荡剪切应力(0.5±4 dyn/cm2) 处理人主动脉内皮细胞(HAECs)会导致 CX3CL1 表达上调、miR-29b-3p 表达下调。
为了进一步验证 miR-29b-3p 在体内对 AS进展的调控作用,研究将 6 周龄雄性 ApoE?/?小鼠分为正常饮食(ND)组和高脂饮食(HFD)组喂养 4 个月,最后 1 个月注射 agomir-miR-29b-3p 或阴性对照(图 6A)。结果显示,HFD 显著降低小鼠主动脉内膜 miR-29b-3p 表达,而注射 agomir-miR-29b-3p 可恢复其表达(图 6B) 并抑制 CX3CL1 的 mRNA 和蛋白水平。生化检测表明,HFD 导致小鼠血清 HDL-C 降低,TG、TC 和 LDL-C 升高,miR-29b-3p 过表达则逆转了这些血脂异常(图 6C-F)。主动脉形态学观察显示,HFD 组小鼠主动脉内膜增厚、斑块形成,而 miR-29b-3p 过表达显著减小了斑块面积(图 6G),油红 O 染色也证实miR-29b-3p 过表达能部分减轻HFD 诱导的主动脉内膜脂质沉积(图 6H-I)。上述结果表明,miR-29b-3p 在体内可改善 AS 进展。
本研究还探讨了miR-29b-3p 是否通过调控 CX3CL1 表达来调节 AS 小鼠的内膜炎症,从而影响 AS 发展。Western blotting 结果显示,miR-29b-3p 过表达逆转了 HFD 喂养的 ApoE?/?小鼠主动脉内膜中 CX3CL1、VCAM-1 和 ICAM-1 的蛋白表达升高(图 6J,K)。免疫组织化学染色也表明,HFD 组小鼠主动脉中 CX3CL1 和 VCAM-1 的表达显著增加,而 miR-29b-3p 过表达则下调了其表达(图 6L)。综上,miR-29b-3p 在体内通过抑制 CX3CL1 及其下游黏附分子的表达,减轻内皮细胞炎症,进而改善 AS。
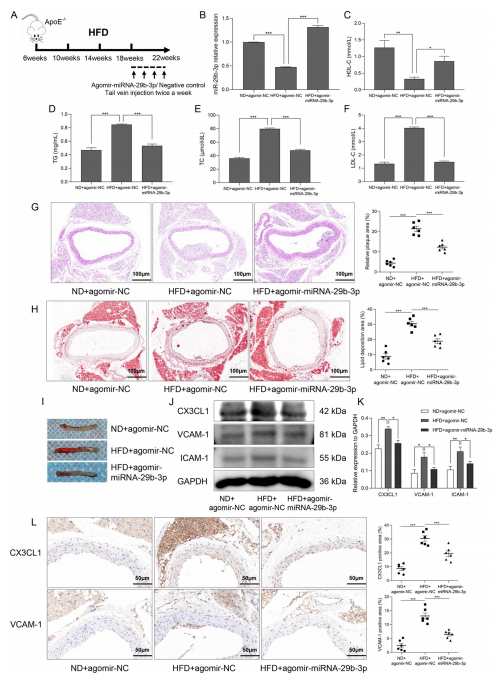
图 6 miR-29b-3p 通过缓解 HFD 诱导的内皮炎症,改善 ApoE?/?小鼠的 AS。
总之,研究揭示了 Lss 敏感的 miR-29b-3p/CX3CL1 轴可显著抑制单核细胞对激活的人主动脉内皮细胞的黏附,并减轻高脂饮食喂养的 ApoE?/?小鼠的局部炎症和斑块形成。
参考文献:Pu L, Meng Q, Li S, Wang Y, Sun B, Liu B, Li F. Laminar shear stress alleviates monocyte adhesion and atherosclerosis development via miR-29b-3p/CX3CL1 axis regulation. J Cell Sci. 2022 Jul 15;135(14):jcs259696. doi: 10.1242/jcs.259696. Epub 2022 Jul 22. PMID: 35735031; PMCID: PMC9450891.
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!关注“Naturethink”公众号,了解更多相关内容。
相关产品
免责声明
- 凡本网注明“来源:Ky开元集团”的所有作品,均为浙江兴旺宝明通网络有限公司-Ky开元集团合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:Ky开元集团”。违反上述声明者,本网将追究其相关法律责任。
- 本网转载并注明自其他来源(非Ky开元集团)的作品,目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。
 手机版
手机版 Ky开元集团手机版
Ky开元集团手机版
 Ky开元集团小程序
Ky开元集团小程序
 官方微信
官方微信 公众号:chem17
公众号:chem17
 扫码关注视频号
扫码关注视频号




















 采购中心
采购中心