外泌体冻干配方的研究
外泌体是由细胞分泌的直径在30~150nm的天然生物纳米囊泡,能够以长、短距离的方式来运输功能性生物分子,是细胞内及细胞间的信使。外泌体因具有生物相容度高、免疫原性低/无、特定组织趋向性、可修饰性以及高稳定性等优势,被作为天然的纳米载体,广泛应用于药物运输和疾病诊断治疗等研究。然而,外泌体的运输和长期储存是限制其临床应用的重要因素。目前外泌体主要以-80℃储存为主,但是该方法的运输成本较高,临床适用性差,因此冻干技术在此方向上的应用被广泛关注。
冻干技术可以实现保持物质活性,防止其被氧化和加水易复原等优势,并且可用于改善纳米载体的稳定性。然而,冻干过程的不良环境会对外泌体造成破坏,因此,需要添加冻干保护剂进行保护。鉴于此,本研究尝试了包括蔗糖、葡萄糖、赖氨酸、海藻糖、乳糖和菊糖在内的冻干保护剂对外泌体完整性、分散性和生物学功能的影响。

通过细胞培养和超速离心法提取细胞上清外泌体、加入冻干保护剂进行溶液配置、外泌体冻干、溶液复溶等工艺步骤后,对冻干后的外泌体进行再评价。
真空冷冻干燥工艺选用,预冻温度-45℃、180min,升华干燥温度-20℃、1200min,解析干燥温度25℃,300min。
通过对外泌体粒径分析、免疫表征、细胞实验等功能性测试,结果表明不同保护剂的保护效果存在较大差异。
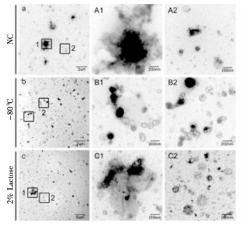
NC:未添加保护剂、-80:对照组、保护剂:2%乳糖
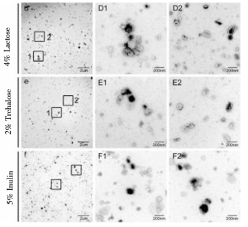
上至下保护剂分别为:4%乳糖、2%海藻糖、5%菊糖
结果讨论:4%乳糖和2%海藻糖能很好地解决冻干时外泌体的聚集和保护外泌体形貌完整的问题,并且4%乳糖和2%海藻糖保护效果相当。考虑到人体对乳糖的不耐受,最终选择了2%海藻糖作为冻干保护剂。使用海藻糖和高分子化合物PVP40结合冻干外泌体时,外泌体完整度和分散度都很好,但使用前需要将PVP40去除,限制了其进一步的应用,故直接使用2%海藻糖会更加方便快捷。为了验证2%海藻糖冻干是否会影响外泌体本身的功能,检测冻干后血浆来源外泌体诱导血管生成功能是否保留,结果发现冻干后的血浆来源的外泌体仍然可以诱导血管上皮细胞成管。同时,添加2%海藻糖冻干后的外泌体常温储存后依旧能被细胞摄取,不会影响外泌体作为纳米载体的进入细胞的固有属性。
免责声明
- 凡本网注明“来源:Ky开元集团”的所有作品,均为浙江兴旺宝明通网络有限公司-Ky开元集团合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:Ky开元集团”。违反上述声明者,本网将追究其相关法律责任。
- 本网转载并注明自其他来源(非Ky开元集团)的作品,目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。
 手机版
手机版 Ky开元集团手机版
Ky开元集团手机版
 Ky开元集团小程序
Ky开元集团小程序
 官方微信
官方微信 公众号:chem17
公众号:chem17
 扫码关注视频号
扫码关注视频号




















 采购中心
采购中心