Mechanosensitive microRNAs - Role in Endothelial Responses to Shear Stress and Redox State
Keywords: Endothelium, Shear Stress, miR, KLF2, Oxidative Stress, Inflammation
血管内皮细胞不仅是血液与血管壁的物理屏障,更通过抗凝、抗炎和抗氧化功能维持血管稳态。体内血流产生的切应力是调控内皮功能的关键因素:直段的脉动切应力(PS)诱导抗氧化与抗炎基因表达,而弯曲分叉处的振荡切应力(OS)则促进促炎与氧化基因激活,这种差异导致动脉粥样硬化的区域性分布,体外 PS 和 OS 模型可模拟这两种血流模式。
微小 RNA(miR)通过形成沉默复合体降解靶 mRNA 或抑制翻译,参与调控内皮细胞的血管生成、血管张力等核心功能。切应力可通过机械转导通路调控 miR 及其宿主基因的转录,形成复杂的调控网络 —— 例如,切应力诱导的 miR 可调控 KLF2、KLF4 等转录因子,而这些因子又能反向调节 miR 表达,且整个网络受时间动态影响,需借助生物信息学工具解析。
基于此,加州大学里弗赛德分校医学院生物医学科学的研究团队在Free radical biology & medicine期刊发表了题为“Mechanosensitive microRNAs - Role in Endothelial Responses to Shear Stress and Redox State”的文章。文章总结了剪切应力调控 miRs 在内皮稳态中的多维度作用,并探讨了通过算法解析 PS 与OS 差异调控的信号网络机制。

miR、KLF2 与功能性内皮细胞
miRNA 调控的关键步骤在于其基因或宿主基因的转录起始阶段,而切应力诱导的转录因子(如 KLF2)可对大量 miRNA 的表达进行调控。作为内皮谱系的主要调节因子,KLF2 既能上调 eNOS、TM、Nrf2 等发挥抗炎、抗血栓和抗氧化作用的基因,又能抑制 VCAM-1、E - 选择素、PAI-1 和组织因子等对内皮功能不利的基因表达。研究预测,KLF2 可转录调控 miR-126、miR-30a、miR-10a 等多个 miRNA。其中,miR-126 具有内皮特异性,可增强 VEGF 信号传导,且在人类中,其转录起始位点上游 - 1 kb 处存在假定的 KLF2 结合位点,斑马鱼研究也证实 klf2a 可通过调控 miR-126 诱导血流刺激的血管生成。
在许多情况下,切应力诱导的转录因子本身在转录水平受到调控。抗动脉粥样硬化的 PS 可激活 MEF5/ERK5/MEF2 和 AMPK 通路,共同促进 KLF2 的转录上调,同时 KLF2 还可通过 HDAC5 磷酸化增加,促使 HDAC 与 MEF2 解离,进而增强 MEF2 对 KLF2 的转录激活;而致动脉粥样硬化的OS 则会通过上调 I 类和 II 类 HDAC 并使其核内积累,促进 MEF2 去乙酰化,从而降低 KLF2 的转录激活。重要的是,KLF2 也直接受 miRNAs 的靶向调控,如 OS 可升高内皮细胞中 miR-92a 的水平,其靶向 KLF2 和 KLF4 的 mRNA,导致 eNOS 等下游基因表达降低,进而引起致动脉粥样硬化血流下的内皮功能紊乱,除已实验验证的 miR-92a 外,生物信息学分析还预测了多个 miRNA 可能靶向 KLF2 mRNA,对这些 miRNA 与血流条件的相关性及内皮细胞反应的研究具有重要意义。
微小 RNA(miR)生物学的进展表明,血流对 KLF2 的调控发生在多个层面,包括转录、转录后和翻译后(图 1)。因此,在研究 KLF2 在ECs对不同血流模式的响应及其与内皮细胞功能结局的关系时,应考虑包括 miR 在内的时间调控网络,而非一系列信号事件的链式反应。
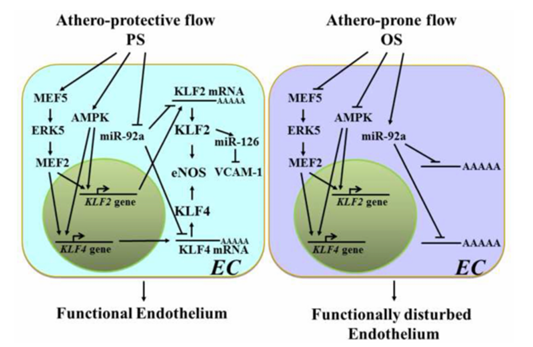
图1 不同血流模式通过对KLF2和KLF4的多层次调控,决定了不同的内皮功能结局。
切应力、内皮细胞氧化还原状态与miRs
致动脉粥样硬化血流(如体内致动脉粥样硬化模式和体外振荡切应力 OS)可通过促进ECs中ROS的产生与积累,导致内皮功能紊乱并推动血管疾病进展。ECs 的氧化还原状态由 NADPH 氧化酶(NOX)、eNOS、SOD 等多种酶介导,而miRs在此过程中起关键调控作用(图 2)。OS 会上调靶向抗氧化基因的 miRs,下调靶向促氧化基因的 miRs,进而破坏氧化还原平衡;相反,抗动脉粥样硬化血流(如体内保护模式和体外脉动切应力 PS)对 miR 网络的调控作用与之相反,可维持氧化还原稳态。相关 miR 对 ECs 氧化还原及炎症状态的调控机制总结于表1。

图 2 响应血流调节内皮细胞氧化还原状态的潜在miR网络示意图。

表1 剪切力诱导的miRs及其在内皮细胞氧化应激和炎症中的作用。
NOX 激活是内皮细胞中 ROS 的主要来源,内皮细胞表达 NOX2 和 NOX4 两种催化亚基,其激活依赖 p47phox 磷酸化及质膜易位结合 p67phox。研究发现 NOX 组分受微小 RNA(miRs)调控,如 NOX4 是 miR-25 的已验证靶点、可能受 miR-23b 靶向,PS诱导的 miR-23b 或通过下调 NOX4 增强血管抗氧化能力;NOX2 亚基 p47phox 可能被 miR-17-5p 等 miRs 靶向,表明剪切应力可通过调控 miRs 靶向多个 NOX 亚基,精细调节 ROS 生成。
SOD 等抗氧化酶通过转化 ROS 维持氧化还原平衡,致动脉粥样硬化流可能通过上调 miRs 抑制抗氧化基因表达。miRs 网络在 PS 与 OS 中呈现复杂调控:miR-21 在 PS 下关联 eNOS 活性发挥保护作用,在 OS 下因靶向 SOD3 等促氧化;miR-30b 可抑制过氧化氢酶,PS 下调的 miR-17 * 靶向多种抗氧化酶基因,OS 或通过 miR-872 下调 SOD1。此外,硫氧还蛋白(Trx)及其相互作用蛋白(Trxnip)可能受剪切应力响应性 miRs 调控,如 miR-17 等靶向 Txnip 具保护作用,Trx 的 miRs 调控机制尚待明确,需进一步研究其对内皮的影响。
内皮型 eNOS 来源的 NO 与 ROS 的平衡是维持内皮功能的关键,NO 生物利用度降低会损害内皮功能。剪切应力通过 miRs 多维度调控 eNOS:PS 诱导的 KLF2 降低靶向 eNOS 的 miR-214,miR-221/222 和 miR-92a 通过靶向 ITGA5 及 KLF2 间接抑制 eNOS;翻译后水平上,PS 通过 AMPK 磷酸化与 SIRT1 去乙酰化协同激活 eNOS,而 OS 下 miR-217 和 miR-33 可削弱该过程。此外,miR-148a 通过抑制促动脉粥样硬化的 ROCK1 增加 eNOS 活性,揭示剪切应力通过 miRNA 网络对 eNOS-NO 通路的多维度调控机制。
剪切应力对内皮细胞炎症状态及 miRs 的调控
内皮细胞的低炎症应激状态是其功能正常的标志之一,而剪切应力通过调控 miRs 影响内皮炎症状态:PS 通过下调促炎分子、上调抗炎 miRs(如 miR-10a、miR-30b、miR-181b)发挥抗炎作用(图 3)。这些 miRs 可通过靶向 MAP3K7、βTRC、importin-33 等分子抑制 NF-κB 通路激活,进而减少 IL-6、VCAM-1 等炎症因子和黏附分子的表达,阻止单核细胞募集;相反,致动脉粥样硬化血流会通过上调促炎分子、下调抗炎分子诱导内皮促炎状态。该机制揭示了剪切应力通过 miR-NF-κB 通路调控内皮炎症反应的关键作用,为动脉粥样硬化等炎症相关心血管疾病的防治提供了新视角。
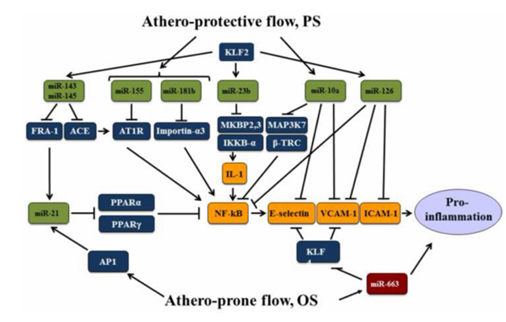
图 3 调控促炎 NF-κB 通路的假定 miR 网络。
AngⅡ 是 NF-κB 通路的强效激活剂,而 PS 可通过上调 miR-155 靶向 AngⅡ 受体 1、上调 miR-143/145 靶向血管紧张素转换酶(ACE)以降低 AngⅡ 水平,从而抑制该通路激活来减轻内皮炎症。KLF2对功能性内皮至关重要,其诱导的 miR-23b 可通过靶向 MAPK 结合蛋白 2 和 3 及 IκB 激酶 -α(IKKB-α)来抑制 NF-κB 和 MAPK8/JNK 通路激活,诱导的 miR-126 能抑制 VCAM-1 及 NF-κB,且 KLF2 诱导的 miR-143/145 可靶向 FRA-1 以抑制 miR-21 转录,进而避免 miR-21 靶向 PPARα 和 PPARγ 而维持 PPARα 对 NF-κB 和 AP-1 通路的抑制作用来负调控促炎基因表达。此外,OS 上调的 miR-663 虽不直接结合 KLF4 mRNA,但敲低 miR-663 可增加 KLF4 转录并减少 VCAM-1 和 E - 选择素转录,而 KLF4 对增强内皮功能起积极作用,故影响 KLF4 上游信号或转录激活的 miRNA 可能对内皮功能产生不利影响。
miRs 在剪切应力调控内皮细胞周期、细胞骨架及间隙连接中的作用
与不同血流模式相关的内皮细胞特异性表型包括增殖或静止等,抗动脉粥样硬化血流下的内皮细胞增殖能力低,其静止状态通过阻止细胞进入 S 期维持,而剪切应力诱导的 KLF2 对该静止状态至关重要。这可能与 KLF2 调控 miR-23b 有关,PS 敏感的 miR-23b 与 Rb 蛋白 E2F1 低磷酸化相关,可增强低磷酸化 Rb 与 E2F1 的抑制性结合以阻滞细胞周期进程,不过 miR-23b 抑制 Rb 磷酸化的机制有待研究。
剪切应力通过影响连接蛋白和 VE-cadherin 等细胞间连接蛋白调节内皮通透性和完整性。紊乱血流可上调内皮细胞中 Cx43,以 PS 为主的动脉区域内皮边界 VE-Cad 表达上调,虽然缺乏剪切应力通过 miRs 调控连接蛋白的直接数据,但连接蛋白和 VE-cadherin 可被 miRs 靶向,故其可能参与剪切应力对内皮通透性的调控。
不同血流模式会使内皮细胞形态不同,OS 或紊乱血流诱导的内皮细胞呈圆形且肌动蛋白丝随机短分布,暴露于 PS 的内皮细胞则伸长并沿血流方向排列,肌动蛋白应力纤维有序平行,剪切应力响应性 miR-155 可能通过降低 RhoA 表达介导血流对内皮细胞骨架组织的影响,而 PAK 表达可被低剪切应力上调,因 miR-126 在斑马鱼中通过抑制 PAK1 调节血管完整性,故推测致动脉粥样硬化血流可能通过抑制 KLF2 诱导的 miR-126 来上调 PAK。
内皮细胞中剪切应力调控 miRs 的未来研究方向
当前对剪切应力调控 miR 及 miR 调控内皮细胞功能的研究,多基于单个或少数时间点的线性分析,而内皮细胞中 miR 调控网络因机械传感器和信号级联的时空参与、多 miR 靶向共同 mRNA、多转录因子调控 miR 基因以及 miR 协同调控细胞表型等因素变得复杂,故未来研究需引入时间分辨率和系统分析方法,以阐明事件间的因果关系。
由于内皮细胞的机械转导反应具有整合性和动态性,涉及多步骤的信号及基因表达调控网络时,需通过时间和因果分析来捕捉代表性组件关系(图 4)。为研究内皮细胞中动态的机械转导网络,可借助 PTMScout 等预测程序推导 PTM 参与的 miR 调控通路,并通过蛋白质组学和基因操作实验验证;利用 TRANSFAC®、JASPAR 等数据库及 ChIP-seq 技术,可确定转录因子与 miR 启动子的结合位置;通过 WormBase WS159 获取 3'UTR 序列并结合 PicTar 等程序可预测 miR 靶标,而 FIRM 算法和 KeyMolnet 模型则能进一步分析 miR 对 mRNA 的直接或间接调控及分子互作网络,为揭示 miR 介导的血流表型机制提供工具。
鉴于内皮细胞表型是机械敏感信号和基因表达事件随时间累积的结果,需借助时间依赖性数据集构建具有时间相关性的 miRNA 网络,而基于分子实验的计算机建模可提升细胞和器官水平功能验证的可靠性。

图 4 推导miR调控网络及信号通路的网络示意图。
总之,体内剪切应力通过机械转导高度调控内皮功能,影响其氧化还原与炎症状态。miRs在内皮细胞响应剪切应力中起关键作用:PS 诱导的 miRs 可抑制氧化应激与炎症,维持血管稳态;OS 则激活相反的 miR 网络。
参考文献:Marin T, Gongol B, Chen Z, Woo B, Subramaniam S, Chien S, Shyy JY. Mechanosensitive microRNAs-role in endothelial responses to shear stress and redox state. Free Radic Biol Med. 2013 Sep;64:61-8. doi: 10.1016/j.freeradbiomed.2013.05.034. Epub 2013 May 30. PMID: 23727269; PMCID: PMC3762952.
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!关注“Naturethink”公众号,了解更多相关内容。
相关产品
免责声明
- 凡本网注明“来源:Ky开元集团”的所有作品,均为浙江兴旺宝明通网络有限公司-Ky开元集团合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:Ky开元集团”。违反上述声明者,本网将追究其相关法律责任。
- 本网转载并注明自其他来源(非Ky开元集团)的作品,目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。
 手机版
手机版 Ky开元集团手机版
Ky开元集团手机版
 Ky开元集团小程序
Ky开元集团小程序
 官方微信
官方微信 公众号:chem17
公众号:chem17
 扫码关注视频号
扫码关注视频号




















 采购中心
采购中心